Chimie organique :
Compétences exigées sur l'introduction à la chimie organique :
Ø Savoir que la chimie organique est la chimie des composés du carbone (et de l'hydrogène).
Ø Déterminer le nombre de liaisons covalentes et le nombre de doublets non liants des principaux atomes de la chimie organique (à partir des règles du « duet » et de l’ « octet »). En déduire la formule de Lewis (2nde).
Ø Représenter les formules développées et semi-developpées de molécules dont on connaît déjà la structure ou la représentation de Lewis (2nde).
Ø Décrire la géométrie des molécules organiques au niveau des atomes de carbone. Utiliser les conventions de Cram pour représenter cette géométrie.
Compétences exigées sur la reconnaissance et la représentation des molécules :
Ø Utiliser correctement les mots de vocabulaire associés à une chaîne : ouverte, cyclique, linéaire, ramifiée, saturée, insaturée ainsi que l'adjectif organique.
Ø Etablir quelques isomères de constitution correspondant à une formule brute.
Ø Représenter les formules développées, semi-développées et topologiques d’une molécule dont on connaît la structure ou la formule de Lewis.
Ø Nommer les hydrocarbures (en se limitant aux chaînes comportant au maximum 6 atomes de carbone). Tenir compte de l’isomérie de configuration Z/E pour la nomenclature des alcènes.
Ø Reconnaître, à partir de leur formule développée, semi-développée ou topologique, les familles suivantes de composés organiques : les composés halogénés, les alcools, les aldéhydes, les cétones, les acides carboxyliques et les amines. Nommer des molécules simples appartenant à ces familles.
Ø Connaître les tests caractéristiques des familles suivantes de composés organiques : les composés halogénés, les alcools, les aldéhydes, les cétones, les acides carboxyliques et les amines.
Compétences exigées sur la chimie du pétrole :
Ø Connaître les variations de la température d’ébullition des alcanes en fonction de la longueur de la chaîne carbonée et du nombre de ramifications.
Ø Connaître le principe de la distillation (fractionnée) et notamment celui lié au pétrole.
Ø Définir le craquage (raccourcissement de la chaîne carbonée...) et le reformage (isomérisation, cyclisation, déshydrogénation...).
Ø A partir d’un monomère (comportant une double liaison C=C) : écrire l’équation-bilan de la réaction de polyaddition (polymérisation) et reconnaître le motif du polymère.
![]() Exercices d'entraînement :
Exercices d'entraînement :
Exercice n°1 : Reconnaissance de groupements caractéristiques en chimie organique (Chap 9)
Entourez et identifiez les groupements caractéristiques dans les molécules suivantes (il y a des pièges !):



![]()
![]()
![]()
Exercice n°2 : Qui suis-je ? (Chaps 8 et 9)
La combustion complète d'une mole d'un hydrocarbure inconnu dans le dioxygène conduit à la formation de six moles de dioxyde de carbone et de six moles de vapeur d'eau.
1) Donnez les formules brutes du dioxygène, du dioxyde de carbone et de l'eau. Déduisez-en l'équation-bilan de cette réaction de combustion et la formule brute de l'hydrocarbure inconnu (on expliquera le raisonnement).
2) A quelle(s) famille(s) peut appartenir cet hydrocarbure ? Justifiez.
3)
![]() Dessiner
les 7 formules topologiques possibles pour l'hydrocarbure, sachant que la chaîne
carbonée la plus longue comporte 5 atomes de carbone (dans le cas des molécules
possédant des isomères Z/E, on ne dessinera qu'un seul d'entre eux). Identifiez
ces 7 formules par des lettres (de A à G).
Dessiner
les 7 formules topologiques possibles pour l'hydrocarbure, sachant que la chaîne
carbonée la plus longue comporte 5 atomes de carbone (dans le cas des molécules
possédant des isomères Z/E, on ne dessinera qu'un seul d'entre eux). Identifiez
ces 7 formules par des lettres (de A à G).
4) L'hydrocarbure inconnu réagit "positivement" avec une solution aqueuse de dibrome. Quelle(s) formule(s) peut-on éliminer ? Justifiez.
5) Sachant que l'hydrocarbure inconnu ne présente pas d'isomérie Z/E, quelles molécules peut-on encore envisager ?
6) Au niveau de la double liaison de l'hydrocarbure inconnu, il n'y a qu'un seul atome d'hydrogène relié aux atomes de carbone. Donnez la formule développée et le nom de l'hydrocarbure inconnu.
Exercice n°3 : Quelques composés organiques (Chaps 8 et 9)
1) Ecrivez les formules de Lewis du butanal, de la propan-1-amine et du 2-chloropent-2-ène.
2) Entourez les atomes de carbone de géométrie tétraédrique dans les molécules suivantes (BBT et pénicilline) :

3) Déterminez la masse molaire de la pénicilline si R correspond à un groupement "méthyl".
Données : Masses molaires de la classification périodique des éléments.
Exercice n°4 : La chimie du pétrole (Chaps 8, 9 et 10)
Le pétrole est un mélange huileux extrait du sous-sol de la Terre, formé essentiellement d’hydrocarbures. Il n’est pas directement utilisable, il doit d’abord être acheminé jusqu’à une raffinerie pour y subir une suite de transformations débutant en général par une distillation.
1)
Expliquez le principe de la distillation du
pétrole (on pourra si nécessaire s’aider d’un schéma clair...).
On se propose dans la suite du problème d’étudier deux des fractions recueillies lors de la distillation du pétrole, fractions nommées : « éther de pétrole » et « essence légère ».
« L’éther de pétrole » :
Cette fraction contient notamment de l’hexane qui est utilisé dans l’industrie des polymères. En effet, un craquage catalytique de l’hexane conduit à l’obtention de deux hydrocarbures en même quantité : A (possédant une double liaison) et B (alcane linéaire).
On réalisant la polymérisation de A, on peut obtenir :
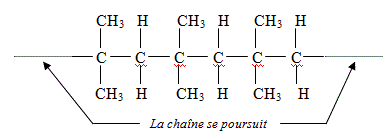
2) a) Donnez le motif du polymère obtenu. Déduisez-en la formule semi-développée et le nom de A (monomère).
b) Numérotez les atomes de carbone de A et précisez leur géométrie.
c) Ecrivez (avec les formules brutes) l’équation du craquage subit par l’hexane,
puis le nom de B.
Par traitement de « l’éther de pétrole », on peut aussi isoler une sous-fraction constituée d’un mélange de 3 alcanes (non cycliques) de même masse molaire M = 72 g.mol-1.
3) a) Rappelez la formule brute générale des alcanes, puis déterminez la formule brute associée à cette sous-fraction.
b) La température d’ébullition de l’alcane linéaire de cette sous-fraction est de 36°C (sous une pression de 1 bar). Comparez cette température d’ébullition à celle du butane. Justifiez.
« L’essence
légère » :
Cette fraction entre, pour une part importante, dans la composition des essences actuelles : super sans plomb 95 et 98. En réalité, les moteurs à essence sont alimentés par un mélange air-carburant. Ce mélange est comprimé dans des cylindres avant qu’il n’explose grâce à une étincelle qui jaillit d’une bougie (d’où le nom de moteur « à explosion »).
Or, il est préjudiciable pour un moteur que le mélange explose durant sa compression (avant l’étincelle). L’indice d’octane d’un carburant (95 ou 98 par exemple) rend compte de la capacité d’un mélange air-carburant à être comprimé sans exploser spontanément. L’indice d’octane 0 est associé à l’heptane (très détonnant pendant la compression) et l’indice 100 à l’isooctane (2,2,4-triméthylpentane) très peu détonnant.

3) 4) Complétez le tableau ci-dessus avec la formule topologique de l’isooctane.
4) 5) On a représenté dans le tableau les
indices d’octane de certains constituants de « l’essence légère ». Quel est
l’intérêt d’un reformage de cette fraction du pétrole (on s’aidera également
de l’énoncé...) ? Quel type de reformage est intéressant ici ?
|
|
3) 6) Représentez la formule de Lewis de D.
7) Il est possible d’obtenir D en faisant réagir de l’acide bromhydrique (H3O+(aq), Br-(aq)) en excès avec un composé C nommé éthan-1,2-diol. Donnez la représentation de Cram de C (les groupements caractéristiques sont dans le plan contenant la(les) liaison(s) entre atomes de carbone).
4) Si on ne fait pas attention aux conditions de conservation et de conditionnement de C (liquide dans les conditions normales), celui-ci peut s’oxyder lentement au fil du temps (oxydation en surface du liquide) en molécules possédant de nouveaux groupements :

8) Combien y a-t-il de groupements caractéristiques différents dans l’ensemble de ces molécules ? Nommez ces groupements.
Données : M(C) = 12,0 g.mol-1 ; M(H) = 1,0 g.mol-1.