La matière organique :
Compétences exigées sur les structures et
les représentations de la matière organique :
Ø
Savoir que les composés (molécules et ions polyatomiques) de la chimie organique
sont constitués entre autres des éléments chimiques carbone et
hydrogène.
Ø Utiliser les règles du duet et de l’octet
ainsi que le numéro atomique Z afin d'établir le nombre
de liaisons covalentes et de doublets non liants des
principaux atomes de la chimie organique (C, H, O, N). En déduire la formule de Lewis
d'une molécule ou d'un ion polyatomique simple.
Ø
Mettre en relation la formule de Lewis d'une molécule (ou d'un ion
polyatomique simple) avec la
géométrie spatiale au niveau des principaux atomes (C, O, N).
Ø
Utiliser et représenter des formules : brutes,
développées, semi-développées (2nde),
topologiques ainsi que des modèles moléculaires
de molécules (2nde).
Ø
Etablir quelques isomères de constitution
correspondant à une formule brute.
Ø
Prévoir si une molécule présente une isomérie
géométrique de type Z/E. Identifier dans des cas simples s'il s'agit
d'un isomère Z ou E..
Ø
Savoir que l'isomérisation photochimique d'une
double liaison C=C est à l'origine du processus de la vision.
Ø
Rédigez un protocole expérimental (tenant compte
des consignes de sécurité) à partir d'un objectif simple, d'une liste de
matériel et de données de sécurité.
 Exercices d'entraînement :
Exercices d'entraînement :
Exercice n°1 : Le dichlorométhane (Chapitre
1)
Le dichlorométhane est un solvant nocif mais il est encore
très largement utilisé dans l'industrie. Il a pour formule brute CH2Cl2.
Déterminez la formule de Lewis du dichlorométhane en
justifiant au préalable le nombre de liaisons et le nombre de doublets non
liants des atomes impliqués.
Données : Z(C) = 6 ; Z(H) = 1 ;
Z(Cl) = 17
 correction
de l'exercice n°1
correction
de l'exercice n°1
Exercice n°2 : Le sel d’aspartame-acésulfame
(d'après contrôle n°2 année 2012,
Chapitre 1)
Le sel d’aspartame-acésulfame est un édulcorant artificiel (E962)
découvert en 1995. Il possède un pouvoir sucrant 350 fois plus élevé que le
saccharose. Ce sel est composé de 2 ions polyatomiques : un positif et un
négatif (ils dérivent respectivement de l’aspartame et de l’acésulfame K) :
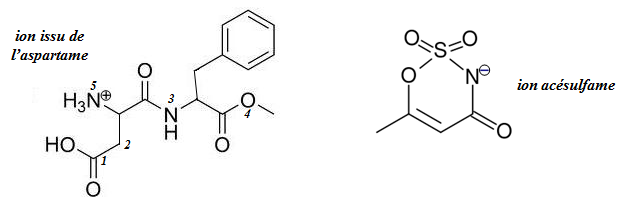
1)
Quel type de formule a été utilisé pour représenter les
ions du sel d’aspartame-acésulfame ?
2)
Donnez la formule semi-développée et la formule brute de
l’ion issu de l’aspartame.
3)
Donnez la nature de la géométrie au niveau de tous les
atomes numérotés de l’ion issu de l’aspartame.
4)
L’ion acésulfame possède un atome de soufre (S) et un
atome d’azote chargé négativement.
a)
Montrez, à partir des données, que le nombre de liaisons
covalentes formées par l’atome d’azote chargé négativement est correct.
Déterminez ensuite, en justifiant, le nombre de doublet(s) non liant(s)
associé(s) à cet atome.
b)
Démontrez que, dans cet ion, l’atome de soufre ne
respecte aucune des règles de stabilité que vous connaissez.
5)
L’ion issu de l’aspartame peut être synthétisé en
laboratoire en plusieurs étapes à partir de l’acide aspartique (C4H7NO4)
et de la phénylalanine. Dessinez deux représentations possibles pour
l’acide aspartique : une en formule développée et une autre sous la forme d’un
modèle moléculaire.
Données : Z(N) = 7 ; Z(S) = 16
 correction
de l'exercice n°2
correction
de l'exercice n°2
Exercice n°3 : Une odeur de
mouffette... (Chapitre 1)
La mouffette encore appelée sconse ou bête
puante (Amérique du Nord) est un animal carnivore noir, avec une double rayure
blanche sur le dos. Cette espèce est surtout distinguée par son habitude à
sécréter des liquides toxiques, très nocifs pour l'odorat comme le (E)-but-2-ène-1-thiol
:
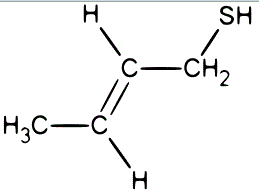 1) Montrez que cette molécule est bien un isomère géométrique de configuration
E.
1) Montrez que cette molécule est bien un isomère géométrique de configuration
E.
2) Déterminez la géométrie au niveau de
tous les
atomes de carbone de la molécule (on pourra numéroter les atomes).
3) Donnez les formules : brute, développée
et topologique de la molécule.
4) Représentez 4 isomères de constitution
du (E)-but-2-ène-1-thiol (2 isomères en formule semi-développée et 2 autres en
formule topologique).
 correction
de l'exercice n°3
correction
de l'exercice n°3
Compétences exigées sur la
matière organique colorée et ses caractéristiques :
Ø
Différencier colorant et pigment
; recueillir et exploiter des informations sur les colorants et les pigments.
Ø
Reconnaître si des doubles liaisons sont conjuguées
(à partir d'une formule).
Ø
Connaître l'effet de l'augmentation du nombre de liaisons
conjuguées sur la longueur d'onde du maximum d'absorption (λmax)
et sur le caractère coloré ou non de l'espèce chimique considérée.
Ø
Connaître quelques paramètres pouvant influencer
la valeur de la longueur d'onde du maximum d'absorption (λmax)
et donc
la
couleur des espèces chimiques (groupements auxochromes,
température, pH, etc...) ; notion d'indicateur coloré.
Ø
Interpréter un chromatogramme
Non évalué lors du contrôle n°2
 Exercice d'entraînement :
Exercice d'entraînement :
Exercice : Extraction d'espèces chimiques
colorées des épinards (Chapitres 1 et 2)
On souhaite extraire grâce à 10 mL de dichlorométhane
(liquide) les espèces chimiques colorées contenues dans 10 g d'épinards
(déjà hachés). La solution finale, où les espèces chimiques extraites seront
dissoutes dans le dichlorométhane, est attendue dans un bécher. La solution
devra être homogène...
1) Rédigez de façon détaillée, à l'aide des données, les étapes d'un protocole expérimental permettant de
réaliser cette extraction. On tiendra compte des mentions de danger du dichlorométhane.
2) Pourquoi ne peut-on pas considérer ici les espèces
chimiques colorées extraites comme des pigments ?
3) L'une des espèces chimiques colorées de la solution
obtenue peut être considérée comme "un indicateur coloré acido-basique".
a) Que signifie l'expression entre guillemets ?
b) Identifiez cette espèce chimique parmi
celles proposées ci-dessous. Justifiez clairement le choix.
1
 2
2
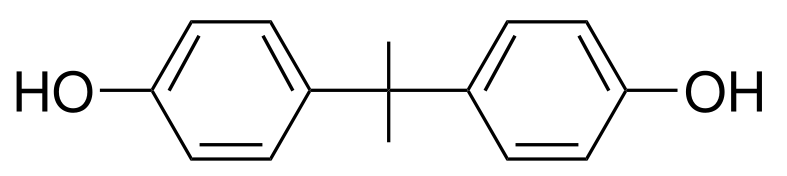
3
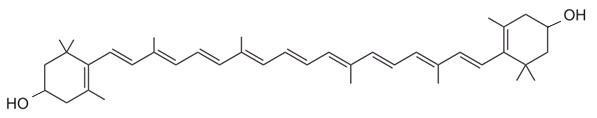
4) Laquelle de ces espèces chimiques (ci-dessus) n'absorbe
pas dans le domaine du visible ? Justifiez.
5) Comment appelle-t-on les groupes d'atomes pouvant
influencer le caractère coloré des espèces chimiques ? Quels sont les effets
possibles de ces groupes d'atomes ?
Données : - Matériel
potentiellement utile
pour réaliser l'extraction dans une salle de TP de chimie :
1 sachet d'épinards hachés ; 1 étuve ; 1 mortier (avec
pilon) ; 1 balance ; 1 coupelle ; 1 spatule ; 1 filtre en papier ; 1 entonnoir
disposée sur une potence ; 1 pissette d'eau distillée ; 1 bécher ; 1 verre à
pied ; des pipettes Pasteur ; 1 éprouvette graduée de 20 mL ; 1 petit flacon contenant du
dichlorométhane ; 1 boîte de gants de protection ; 1 paire de lunettes de
protection ; des petits pots ; 1 bain-marie ; du sopalin ; du savon
- Mentions de danger du dichlorométhane :
Liquide et vapeurs inflammables ; provoque une irritation cutanée
; provoque une sévère irritation des yeux ; peut irriter les voies respiratoires
; peut provoquer somnolence ou vertiges ; susceptible de provoquer le cancer
 correction
de l'exercice
correction
de l'exercice
Compétences exigées sur la
synthèse de matière colorée :
Ø
Déterminer la quantité de matière n ou la
masse m d'une espèce chimique en fonction des données de l'énoncé et de
l'état physique de l'espèce chimique.
Ø
Connaître les notations et savoir calculer les valeurs des
grandeurs suivantes : masse molaire, volume,
densité, masse volumique,
concentrations molaire et massique.
Ø
Connaître le matériel de base de chimie ; choisir le matériel de
chimie en fonction d'un objectif et l'utiliser correctement (en tenant compte
des consignes de sécurité).
Ø
Identifier les réactifs et les produits d'une transformation
chimique. Ecrire l'équation-bilan (équilibrée) d'une réaction
chimique.
Ø
Construire et compléter de façon littérale un tableau
d'avancement.
Ø Déterminer
le réactif limitant d'une transformation chimique à l'aide d'un
tableau d'avancement et/ou des changements de couleur (ou d'état physique,
etc...) des
composants du milieu réactionnel.
Ø
Déterminer la composition qualitative et
quantitative d'un système chimique (initial et final).
 Exercices d'entraînement :
Exercices d'entraînement :
Exercice n°1 : Etude d'une transformation
chimique (Chapitre 3)
On verse 5,0 mL d'une solution aqueuse d'ammoniac (NH3)
de concentration massique 50,0 g/L dans un erlenmeyer contenant déjà 20 mL d'une
solution aqueuse contenant des ions hypochlorite ClO- (on a : [ClO-]
= 1,5 mol.L-1). Une transformation chimique a lieu. Il y a formation
d'un composant de l'air : le diazote, mais également d'ions chlorure Cl-
et d'eau liquide.
Avant de réaliser cette expérience, on s'intéresse aux
pictogrammes de la bouteille contenant la solution d'ammoniac :


1) Quelles sont les consignes de sécurité particulières qu'il
faut respecter pour réaliser la transformation chimique ?
2) Donnez l'équation-bilan associée à cette transformation
chimique.
3) Déterminez dans l'état initial : la masse d'ammoniac, puis
les quantités de matière des réactifs.
4) Etablissez le tableau d'avancement relatif à cette
transformation chimique (les quantités de matière de diazote et d'eau ne sont
pas nulles, on les notera ni(diazote) et ni(eau)).
5) Déterminez l'avancement maximal puis le réactif limitant.
6) Déterminez la masse d'eau qui a été
produite. Calculez le volume d'eau correspondant en m3.
Données : M(N) = 14,0 g.mol-1
; M(H) = 1,0 g.mol-1 ; M(O) = 16,0 g.mol-1 ;
ρeau = 1,0×103 g.L-1.
 correction
de l'exercice n°1
correction
de l'exercice n°1
Exercice n°2 : Synthèse de l'acide éthanoïque
(Chapitre 3)
L'acide éthanoïque (ou acide acétique) C2H4O2(l)
est naturellement présent dans le vinaigre, il lui donne son goût acide et son
odeur piquante. Il est très utilisé en industrie en tant qu'additif alimentaire,
en photographie, dans la fabrication de plastiques, de peintures, d'adhésifs, en
tant que solvant organique etc... Il existe différents procédés de fabrication
de cet acide. L'un d'entre eux consiste a chauffé (à 150°C et sous une pression
de 55-60 bars) du butane C4H10
(qui est alors liquide) avec du dioxygène en présence de différents ions métalliques jouant le rôle de
catalyseurs. Il se forme également de l'eau liquide.
1) Donnez deux formules développées possibles pour l'acide
éthanoïque. Comment peut-on alors qualifier ces molécules ?
2) Ecrivez l'équation-bilan de la synthèse de l'acide
éthanoïque sachant qu'il est obtenu à l'état liquide.
Au cours d'une synthèse où le butane est le réactif limitant,
on produit un mélange contenant de l'eau et de l'acide éthanoïque. Après
séparation, on obtient dans des conditions classiques de température (20°C) et
de pression un volume de 200 L d'acide éthanoïque considéré comme pur.
3) Déterminez la masse d'acide éthanoïque produit en kg, puis
sa quantité de matière. On suppose qu'il n'y a pas eu de perte au cours de la
séparation...
4) Construisez le tableau d'avancement théorique relatif à la
synthèse.
5) Déterminez, en expliquant, l'avancement maximal de la
synthèse puis la quantité de matière consommée de butane.
6)  De quelle(s) donnée(s) aurait-on eu besoin pour déterminer
le volume de dioxygène consommé ? Comment aurait-on obtenu le résultat ?
De quelle(s) donnée(s) aurait-on eu besoin pour déterminer
le volume de dioxygène consommé ? Comment aurait-on obtenu le résultat ?
Données : dacide éthanoïque
= 1,049 à 20°C et sous pression atmosphérique ; ρeau
= 1,0×103 g.L-1 ; M(H) = 1,0 g.mol-1 ;
M(O) = 16,0 g.mol-1 ; M(C) = 12,0 g.mol-1.
 correction
de l'exercice n°2
correction
de l'exercice n°2
![]() Exercices d'entraînement :
Exercices d'entraînement :
 1) Montrez que cette molécule est bien un isomère géométrique de configuration
E.
1) Montrez que cette molécule est bien un isomère géométrique de configuration
E. 2
2


