Compétences exigées :
Ø Interpréter la couleur d'une solution à partir des longueurs d'onde des lumières absorbées par la solution. Utiliser un cercle chromatique.
Ø Interpréter la couleur d'un mélange obtenu à partir de matières colorées, à l'aide, par exemple, de la synthèse soustractive.
Ø Connaître la loi de Beer-Lambert sur l'absorbance.
Ø Réaliser des dilutions.
Ø Mettre en œuvre un protocole pour déterminer la concentration (molaire ou massique) d'une espèce chimique colorée (présente en solution) à l'aide d'une droite d'étalonnage.
![]() Exercices d'entraînement :
Exercices d'entraînement :
Exercice : Sirop de menthe
L'étiquette d'un sirop de menthe indique qu'il contient deux colorants alimentaires de code E102 et E131. L'étiquette n'indique pas leur concentration. On se propose de déterminer les concentrations massiques de ces colorants alimentaires par spectrophotométrie.
On étudie dans un premier temps les graphiques suivants :


1) Déterminez, à l'aide des graphiques ci-dessus, la couleur du colorant E102 et celle du colorant E131.
Pour chaque colorant alimentaire, on réalise une série de 6 solutions étalons de concentrations différentes à partir d'une solution "mère" de concentration massique valant Cm0 = 0,100 g/L. On mesure ensuite l'absorbance de chacune de ces solutions :
|
Numéro de solution |
1 |
2 |
3 |
4 |
5 |
6 |
|
Concentration
massique (mg/L) |
5,0 |
10,0 |
12,5 |
15,0 |
20,0 |
25,0 |
|
Absorbance pour
λ = 450 nm |
0,26 |
0,41 |
0,50 |
0,61 |
0,83 |
1,00 |
|
Numéro de solution |
1 |
2 |
3 |
4 |
5 |
6 |
|
Concentration
massique (mg/L) |
2,0 |
4,0 |
5,0 |
6,0 |
8,0 |
10,0 |
|
Absorbance pour
λ = 630 nm |
0,38 |
0,58 |
0,74 |
0,88 |
1,08 |
1,41 |
2) Quel volume V0 de solution "mère" aurait-on du prélever pour préparer 25 mL de la solution n°5 du premier tableau ?
3) A quel colorant correspondent les données du premier tableau ? et celles du second tableau ? Justifiez les réponses.
4) Sur une même feuille de papier millimétré, tracez l'évolution de l'absorbance en fonction de la concentration massique pour chaque colorant. On respectera les échelles suivantes :
1 cm ↔ 1 mg/L pour les concentrations massiques et 1 cm ↔ 0,1 pour les absorbances
5) a) Quelles relations mathématiques (littérales) peut-on déduire de ces 2 tracés ?
b)
![]() Faîtes le lien entre
la loi de Beer-Lambert et ces relations mathématiques littérales.
Faîtes le lien entre
la loi de Beer-Lambert et ces relations mathématiques littérales.
6)
![]() Le sirop de menthe
contient 2 colorants alimentaires qui absorbent donc de la lumière dans le
domaine visible. Pourquoi pourra-t-on quand même ici déterminer, sans problème,
les concentrations massiques de chaque colorant ?
Le sirop de menthe
contient 2 colorants alimentaires qui absorbent donc de la lumière dans le
domaine visible. Pourquoi pourra-t-on quand même ici déterminer, sans problème,
les concentrations massiques de chaque colorant ?
L'étalonnage est maintenant terminé et on peut l'utiliser pour déterminer les concentrations inconnues des deux colorants alimentaires dans le sirop de menthe. Pour cela, on dilue au préalable le sirop de menthe d'un facteur 10. On mesure ensuite les absorbances utiles de l'échantillon de sirop dilué : à 450 nm, on obtient une absorbance de 0,51 et à 630 nm, l'absorbance vaut 0,91.
7) Avec quel appareil mesure-t-on toutes les absorbances ?
8) Déterminez la concentration massique de chaque colorant alimentaire dans l'échantillon dilué, puis dans le sirop de menthe.
Donnée : On pourra utiliser un cercle chromatique.
Solutions ioniques et moléculaires :
Compétences exigées :
Ø Savoir qu'un solide ionique (électriquement neutre) est composé d’anions (-) et de cations (+). Connaître le nom et la formule de quelques ions courants.
Ø Interpréter la cohésion d'un solide ionique à l'aide des interactions électriques attractives entre ions.
Ø Interpréter la cohésion d'un solide moléculaire à l'aide des forces de Van der Waals et éventuellement à l'aide des liaisons hydrogène.
Ø Prévoir si un solvant est polaire ou apolaire (à partir de sa formule ou d'une représentation moléculaire par exemple et en s'aidant du caractère plus ou moins électronégatif des atomes).
Ø Ecrire la formule d’un solide ionique et l’équation-bilan symbolisant sa dissolution dans l’eau.
Ø Savoir qu'une solution ionique ou moléculaire est électriquement neutre.
Ø Utiliser le caractère polaire ou apolaire d'un solvant pour expliquer la plus ou moins bonne dissolution d'un soluté (ionique ou moléculaire).
Ø Recueillir et exploiter des informations sur les applications de la structure de certaines molécules (ou composés ioniques) comme les alginates, les tensioactifs...
Ø Déterminer la concentration molaire C d’un soluté et les concentrations molaires des espèces chimiques réellement présentes en solution ([...]).
Ø Elaborer et réaliser à l'aide des ustensiles de chimie nécessaires, un protocole de préparation d'une solution ionique (ou moléculaire) de concentration donnée en ions (ou en molécule). La méthode utilisée peut être une dissolution ou une dilution (2nde).
Ø Mettre en œuvre un protocole pour extraire une espèce chimique d'une solution (à partir d'informations sur l'espèce chimique, le solvant etc...). Réaliser une extraction par solvant à l'aide d'une ampoule à décanter (2nde).
![]() Exercices d'entraînement :
Exercices d'entraînement :
Exercice n°1 : Solution de phosphate de sodium
Le phosphate de sodium est un cristal ionique composé d’ions sodium et d’ions phosphate PO43-.
1) Expliquez la cohésion des cristaux ioniques comme celui-ci.
2) Donnez la formule du phosphate de sodium en la justifiant.
On souhaite préparer un volume V = 100 mL d’une solution aqueuse de phosphate de sodium en dissolvant une quantité de matière n = 25 mmol.
3) Calculez la masse m de phosphate de sodium à dissoudre.
4) Rédigez précisément le protocole expérimental de la préparation de cette solution.
5) a) Démontrez que l'eau est une molécule polaire.
b) Au niveau microscopique, que s'est-il passé entre le solide ionique et les molécules d'eau pour expliquer la dissolution ?
6) Donnez l’équation-bilan de la dissolution du phosphate de sodium dans l’eau.
7) Calculez la concentration massique Cm et la concentration molaire C en soluté apporté.
8) Déterminez les concentrations molaires des ions présents dans la solution préparée.
Données : classification périodique des éléments chimiques
Exercice n°2 : Solubilité d'espèces chimiques
Une ampoule à décanter contient deux solvants : on y a versé 30 mL d'éther diéthylique et 30 mL d'eau distillée. Ces deux solvants sont assez peu miscibles : on ne peut solubiliser au maximum que 69 g d'éther diéthylique dans exactement 1 litre d'eau.
1) a) Quelle masse maximale d'éther diéthylique peut-on dissoudre dans 30 mL d'eau ?
b)
![]() Quel volume représente
cette masse maximale ?
Quel volume représente
cette masse maximale ?
c) Voit-on 1 ou 2 phases dans l'ampoule à décanter ? Justifiez. Le mélange est-il homogène ou hétérogène ?
On dispose des espèces chimiques : chlorure de sodium, éthanol et octane et des informations suivantes :
|
Espèce chimique |
Solubilité dans l’eau |
Solubilité dans l’éther diéthylique |
|
Chlorure de sodium |
très grande |
nulle |
|
Octane |
nulle |
très grande |
|
Ethanol |
très grande |
très grande |
2) Pourquoi la solubilité de l'éthanol dans l'eau est-elle "très grande" ?
3) a) Est-ce que l'octane est une molécule polaire ? Justifiez.
b) Quelle(s) force(s)/interaction(s) explique(nt) la cohésion de l'octane ?
On verse des petites quantités des 3 espèces chimiques dans l'ampoule à décanter et on agite correctement l'ampoule à décanter.
4) a) Où va se retrouver l'éthanol ?
b) Faîtes un schéma légendé de l'ampoule à décanter. Justifiez l'ordre et la composition des phases.
Données : ρeau = 1000
g/L ; deau = 1 ; déther
diéthylique = 0,71 ; formule de l'éthanol : CH3-CH2-OH
; formule de l'octane :![]() ;
classification des éléments chimiques pour les différences d'électronégativité
;
classification des éléments chimiques pour les différences d'électronégativité
Exercice n°3 : Agent de coagulation
Dans une station d'épuration, les eaux usées subissent d'abord une filtration grossière, puis elles sont versées dans une cuve où est ajouté ce que l'on appelle : un coagulant, qui fait en sorte que les particules contenues dans les eaux s'agglomèrent (puis décantent pour ensuite être éliminées par filtration). Le sulfate d'aluminium est couramment utilisé comme agent coagulant ; il est ajouté sous forme de solution aqueuse.
A-Préparations de solutions :
On prépare une solution aqueuse coagulante en dissolvant du sulfate d'aluminium solide dans de l'eau distillée. Ce sulfate d'aluminium est en fait un solide ionique octodécahydraté.
1) a) Que signifie "octodécahydraté" ?
b) Déterminez, en justifiant, la formule du solide ionique.
On dissout 300 g du solide précédent dans un volume de 1,0 m3. On récupère ensuite dans une bouteille environ 1 L de cette solution (notée S0).
2) a) Ecrivez l'équation-bilan de la dissolution du solide ionique.
b) Les ions présents dans la solution sont "hydratés". Qu'est-ce que cela signifie au niveau microscopique ?
3) On désire faire des tests avec une solution S de 100 mL de concentration en soluté apporté valant 0,060 g/L. On va préparer cette solution à partir de S0.
a) Quelle méthode va-t-on utiliser ici ? Que faut-il calculer afin de pouvoir préparer cette solution S ?
b) Réalisez les calculs nécessaires et rédigez un protocole détaillé de préparation de la solution S.
B-Utilisation de la solution coagulante :
1) Les particules présentes dans l'eau sont souvent assez petites (colloïdes) et de charge électrique négative. Pourquoi n'ont-elles pas tendance à s'agglomérer de façon naturelle ?
2) Avec l'ajout de la solution coagulante, des ions vont préférer se fixer (s'adsorber) sur les colloïdes plutôt que de rester hydratés, afin de neutraliser (ou du moins d'abaisser) la charge électrique de ceux-ci. Quels sont ces ions ? Justifiez.
Au pH habituel des eaux usées, il y a aussi, formation d'ions complexes tels que Al(H2O)(OH)2+, Al(H2O)4(OH)2+... Ces formes peuvent établir des doubles-ponts OH entre les atomes d'aluminium :
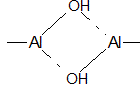
On a ainsi formation d’espèces chimiques appelées polymères (en raison de leur longue chaîne d'atomes) dont notamment Al2(OH)24+, Al3(OH)45+, Al6(OH)153+, Al13(OH)327+ jusqu’à Al54(OH)14418+. Ces espèces chimiques fortement chargées sont aussi importantes lors de la coagulation (voir ci-dessous pour un exemple) :
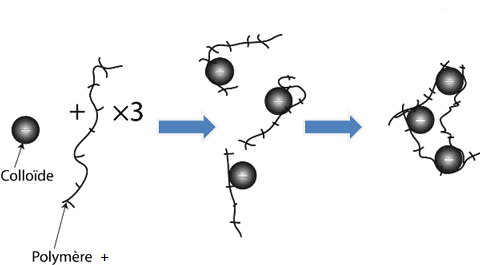
3) Comment agissent ces polymères ? Comment expliquer la formation de gros agglomérats ?